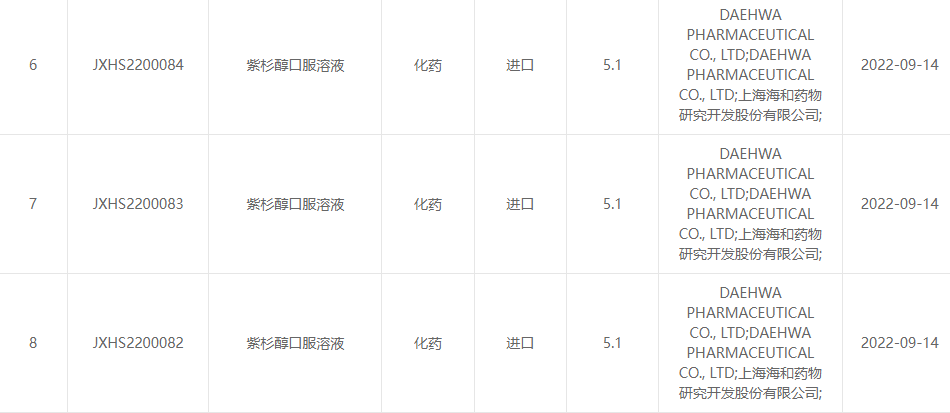
2022ko irailaren 13an, Shanghai Haihe Pharmaceutical Research and Development Co., Ltd. eta Daehwa Pharmaceutical Co., Ltd.-ek elkarrekin iragarri zuten bi alderdiek elkarrekin garatutako paclitaxel ahozko irtenbidea (RMX3001) Droga Zentroak ofizialki onartu zuela. Droga Estatuko Administrazioaren Ebaluazioa (CDE).(Onarpen-zenbakia: JXHS2200082 herrialdea, JXHS2200083 herrialdea, JXHS2200084 herrialdea).
Irudiaren iturria: Droga Estatuko Administrazioa
Paclitaxelasko erabiltzen da hainbat tumore gaiztoen tratamenduan, hala nola biriketako minbizia, bularreko minbizia, obulutegiko minbizia, buruko eta lepoko minbizia eta urdaileko minbizia.Proteinen polimerizazioa, mikrotubuluen muntaketa, despolimerizazioa saihestuz, mikrotubuluak egonkortuz eta minbizi-zelulen mitosia inhibituz eta apoptosia eraginez, minbizi-zelulen ugaltzea eraginkortasunez saihestuz eta minbiziaren aurkako efektua jokatzeko.
Gaur egun, munduko toki gehienek paclitaxel injekzio moduan erabiltzen dute, eta hori ospitalean bena barneko tanta bidez formulatu eta administratu behar da.Pazienteak maiz itzuli behar dira ospitalera, eta erreakzio kaltegarriak izango dira injekzio gunean.Hori dela eta, ahozko paclitaxel prestakinen garapena beti izan da industria-ikerketetan puntu beroa..
RMX3001 Dahua Pharmaceutical-ek garatutako paclitaxel-en ahozko formulazioa da, bere lipidoen autoemultsionatzeko sendagaiak emateko teknologia berritzailean oinarrituta.Koreako Elikagaien eta Droga Administrazioak 2016ko irailean onartu zuen (Liporaxel izen komertziala), eta adierazlea metastasiaren minbizi metastasikoaren edo lokalean errepikatzen den minbizi gastrikoaren tratamendu aurreratua edo bigarren lerrokoa da.Haihe Pharmaceuticals-en prentsa-ohar baten arabera, Liporaxel orain arte munduan arrakastaz garatu eta merkaturatzeko onartu den ahozko lehen paclitaxel produktua da.2017ko irailean, Haihe Pharmaceutical-ek produktuaren I+G, ekoizpen eta salmenta eskubideak lortu zituen Txina kontinentalean, Hong Kongen, Taiwanen eta Thailandian Dahua Pharmaceuticals-en eskutik.
Txinan RMX3001 zerrendaren aplikazioa, batez ere, ausazko, etiketa irekia, paralelo-kontrolatuta, gutxiagotasunik gabeko diseinuan oinarritzen da, zentro anitzeko 3. faseko entsegu klinikoan, zeinak paclitaxel RMX3001 ahozko soluzioaren bigarren lerroko tratamendua alderatzea helburu duena. paclitaxel injekzioa (Taxol) Eraginkortasuna eta segurtasuna minbizi urdaileko aurreratua duten pazienteetan.Shanghaiko Ekialdeko Ospitaleko Li Jin irakasleak eta Nanjing Jinling Ospitaleko Qin Shukui irakasleak elkarrekin egin zuten ikerketa ikertzaile nagusi gisa.
Ruiping Dong doktoreak, Haihe Pharmaceuticals-eko zuzendari nagusiak, esan zuen: "Paclitaxel ahozko soluzioaren eskaera (RMX3001) onartzea beste mugarri garrantzitsu bat da Haihe Pharmaceuticals-entzat, eta asko eskertzen diet gurean parte hartu duten ikertzaile klinikoei eta pazienteei. epaiketa.Urdaileko minbizi aurreratua Tratamenduaren premia kliniko bete gabe dago oraindik, eta munduko tratamendu berritzaile eta erosoenak Txinako eta mundu osoko pazienteei ahalik eta azkarren ekartzea espero dugu».
Yunnan Hande Biotechnology Co., Ltd.-ek 28 urte daramatza paclitaxelaren ekoizpenean zentratzen.AEBetako FDAk, Europako EDQMk, Australiako TGAk, Txinako CFDAk, Indiak, Japoniak eta beste erakunde erregulatzaileek onartutako landare-jatorrizko paclitaxel sendagaiaren munduko lehen fabrikatzaile independentea da.enpresa.Erosi nahi baduzuPaclitaxel APIa,mesedez jarri gurekin harremanetan sarean.
Argitalpenaren ordua: 2022-09-14